微生物药敏试验(二):稀释法
发布时间:2025-02-24 浏览次数:543
一、药敏试验中相关概念
1.CLSI:The Clinical and Laboratory Standards Institute,简称CLSI,其前身是NCCLS。CLSI标准包括抗菌药物敏感性试验执行标准(M3-A),其中包括了各类抗菌药物的敏感性和耐药的判断标准,感兴趣的友友可以去官网查看。
2.MIC:Minimal Inhibitory Concentration,最低抑菌浓度,能够抑制受试菌生长的最低抗生素浓度。它反映了细菌对药物的敏感性,是衡量药物抑制细菌生长能力的指标。通常情况下,MIC大于等于MBC,这意味着药物在达到抑制细菌生长的浓度时,通常也具备了杀灭细菌的能力。
3.MBC:Minimal Bactericidal Concentration,最小杀菌浓度,指杀死99.9%(降低3个数量级)的受试菌所需的最低药物浓度。这一指标用于评估抗菌药物的效果,确保药物能够有效杀灭大部分细菌,从而保护患者免受感染。
4.MIC50:在一批实验中,能够抑制50%受试菌所需的最小抑菌浓度。它提供了一个基准点,表明了药物在多大程度上能够影响细菌群体的一半。
5.MIC90:能够抑制90%受试菌所需的最小抑菌浓度。这表明了药物在更大范围内的有效性,即它能够在多大程度上影响细菌群体的绝大部分。
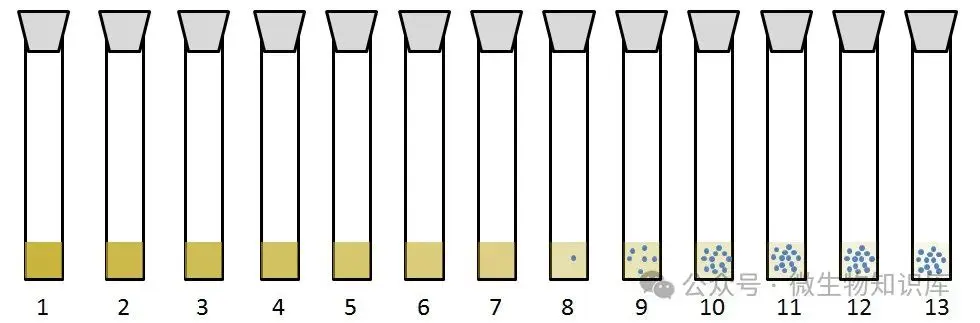
注意:颜色代表抗菌药物的浓度,蓝色圆球代表菌浓。该图仅供模拟数据,不具有实际意义。
比如说,第1-7支试管中,无受试菌生长,说明受试菌生长受到抑制或被杀死,第7号试管中抗菌药物浓度即是最小抑菌浓度MIC ,是一个具体浓度值,每次试验都有一个MIC值。
MIC50和MIC90:是统计学参数,测定多个受试菌的MIC值,然后将这些MIC值从小到大排序,找到排在中间位置的MIC值,即为MIC50,同理抑制90%受试菌生长的浓度即为MIC90。
但,这些数据都是大量数据得出的结论,绝不能只是单次试验结果。
二、纸片扩散法和稀释法的异同
前面一节我们学习了微生物药敏试验(一):纸片扩散法,这一节继续学习微生物药敏试验(二):稀释法,先了解一下二者异同。
两种方法都是药敏试验常用方法,目标相同、原理相似、操作步骤和结果评估都相似,是相似但不是相同。
1.操作方法不同
纸片扩散法是将含有定量抗菌药物的滤纸片贴在已接种了受试菌的琼脂表面上,观察受试菌的生长情况或抑菌圈大小;而稀释法是用MH肉汤将抗菌药物进行一系列稀释后,然后添加受试菌,观察受试菌生长情况。
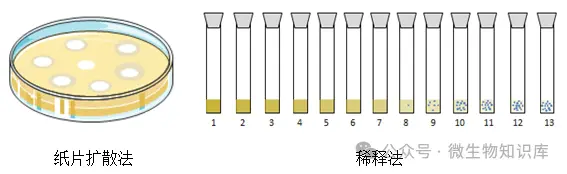
2.表现形式不同
纸片扩散法是随着抗菌药物扩散距离的增加抗菌药物的浓度呈对数减少,从而在纸片的周围形成一种透明圈;而稀释法是抑制受试菌肉眼可见生长的最低药物浓度,即为该药物对受试菌的最低抑菌浓度(MIC)。
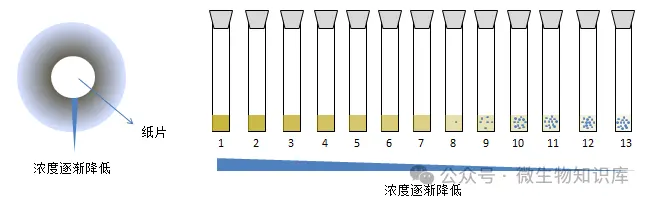
3.研究性质不同
纸片扩散法是定性药敏试验,简便易行,适用于实验室常规使用;稀释法是定量药敏试验,可确定受试菌对某抗菌药物的MIC和MBC。
因此,稀释法可作为评价标准,特别是琼脂稀释法被誉为金标准。
三、稀释法原理
将一定浓度的抗菌药物进行一系列对倍稀释后,接种受试菌株,经孵育后观察细菌生长情况,分析药敏结果,可定量检测该抗菌药物的最低抗菌浓度(MIC)、最小杀菌浓度(MBC)、可抑制50%受试菌的MIC(MIC50)、可抑制90%受试菌的MIC(MIC90)。此法较少应用于临床检测,多用于耐药的调查。
四、肉汤稀释法操作步骤
稀释法药敏试验主要有试管肉汤稀释法、微量肉汤稀释法、琼脂稀释法等方法,其主要区别为培养基状态和含量不同,但试验步骤基本一致。我们这里学习一下试管肉汤稀释法。
1.抗菌药物稀释
按照CLSI制订的指南进行抗菌药物原液制备和稀释。比如,抗菌药物溶剂的选择,pH调节,稀释液的选择等。
2.受试菌菌液制备
挑取活化好的受试菌制备成0.5麦氏单位菌悬液。
3.菌株接种
配制好菌悬液后,在15min内接种完成。
按照试管肉汤稀释法和微量肉汤稀释法最终接种菌量为105CFU/mL,琼脂稀释法最终接种菌量为104CFU/mL进行接种。
4.孵育
接种完毕后,将试管放入35℃恒温培养箱中培养16~20h。
不同的微生物培养时间不同。
5.结果分析
检查对照组生长情况,用肉眼观察或比浊法读取数据。
五、稀释法在普通微生物实验室中应用实例
1.菌种
大肠杆菌受试菌种,大肠杆菌标准菌株。
2.培养基和试剂
按照CLSI制订的指南进行抗菌药物原液制备。
按照配方配制MH液体培养基。
3.菌液制备
采用划线法将大肠杆菌受试菌种和标准菌种接种于营养琼脂平板,35℃培养16-18h,然后挑取单菌落,重悬于3mL无菌生理盐水中,混匀后与标准比浊管比浊。调整浊度与标准比浊管0.5麦氏相同,使用前稀释100倍。
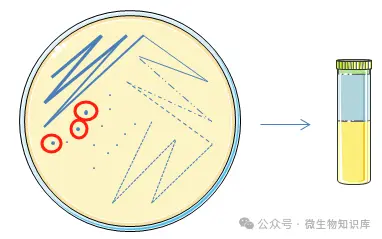
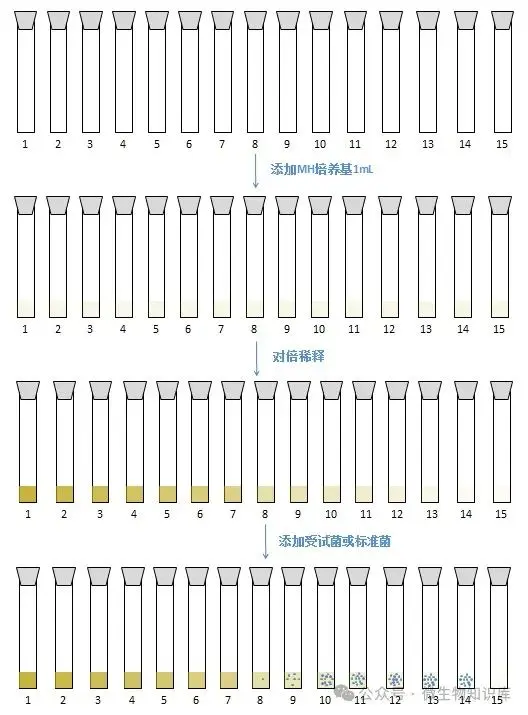
4.准备试管
准备15支无菌试管,标记1-1—1-15。
另取15支无菌试管,标记2-1—2-15。
5.添加稀释培养基
用移液器向每管中加入1mLMH液体培养基。
6.抗菌药物对倍稀释
吸取抗菌药物原液1mL至第1支试管中,混匀;从第1支试管中取出1mL加入第2支试管中,混匀;依次对倍稀释,直到第13支试管,混匀。
两组1-13试管处理一致。
7.加入受试菌和标准菌菌悬液
1-1—1-14管中加入受试菌1mL,混匀,第14管作对照组(没有抗菌药物,只有培养基和受试菌),第15管作空白对照(只有培养基)。
2-1—2-14管中加入标准菌1mL,混匀,第14管作对照组(没有抗菌药物,只有培养基和标准菌),第15管作空白对照(只有培养基)。
8.培养
将各试管放入35℃恒温箱中培养12-18h。
9.观察
检查空白对照组中是否污染、对照组受试菌生长情况,显微镜看观察对照组是否污染杂菌。
10.结果
空白对照组无污染、对照组受试菌生长良好且无污染,即可进行筛选MIC。
(1)观察法:通过观察,抗菌药物最低浓度管无细菌生长,即为受试菌的最低抑菌浓度(MIC)。
多次试验后,根据前面我们提到的相关概念方法中,找出MIC50和MIC90,尤其是MIC90。
(2)比浊法:使用可见分光光度计测定各管的浊度(通常在波长为600nm处进行检测),空白对照组(未加菌液)作对照,接近为0的最低药物浓度即为MIC。
五、其他稀释法
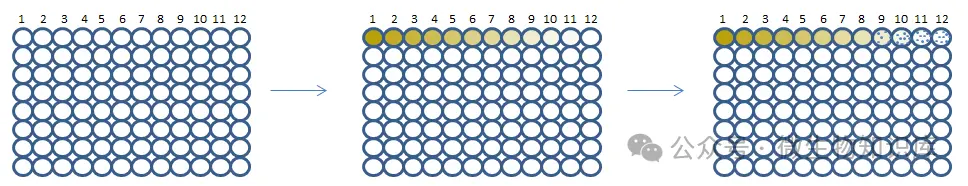
1.微量稀释法
微量稀释法使用的不是试管,是96孔板,比如说每个孔中加入200μLMH培养基,然后第1个孔中加入200μL抗菌药物原液,混匀,依次对倍稀释,混匀。加入10μL受试菌菌悬液,混匀,培养。
2.琼脂稀释法
琼脂稀释法用到的培养基是琼脂培养基。抗菌药物经一系列对倍稀释后,琼脂培养基融化至合适温度(比如45℃),不同梯度抗菌药物与琼脂培养基的混合(通常为1:9),最后将混合好的含抗菌药物琼脂培养基迅速倾倒入已灭菌的培养皿中(通常厚度为4mm)。

值得注意的是,在琼脂稀释法中,接种使用的是点接种不是涂布平板。即:使用多点接种器或无菌吸管等工具,吸取制备好的菌液(约1μL),在琼脂表面点接菌,直径约8mm。
六、注意事项
1.保证抗菌药物质量
抗菌药物应从正规机构购买,已知效价和纯度,按照说明书进行保存,配制好的液体过滤除菌。
2.保证受试菌质量
按照要求,严格分离受试菌,受试菌合格的标本才能获得合格的结果。取样、检查过程中,要进行严格无菌操作,保证标本清洁。
3.培养基的要求
不同微生物需要不同的培养基,特殊微生物还需要添加特殊的试剂。
4.结果分析
试验结果可能会出现跳孔现象,就是某一个抗菌浓度试管中不长菌,前后两个梯度都长菌的情况,遇到这种情况首先需要检查测试菌的纯度,其次检查抗菌药物是否加错,总之,重做试验是躲不过啦。
文章来源:环凯转载于“ 微生物知识库”公众号;原标题:“微生物药敏试验(二):稀释法”;作者~发酵菌人。
转载声明:本文为转载发布,仅为分享学习目的。对转载有异议和删稿要求的原著方,可联络站点客服删除。





